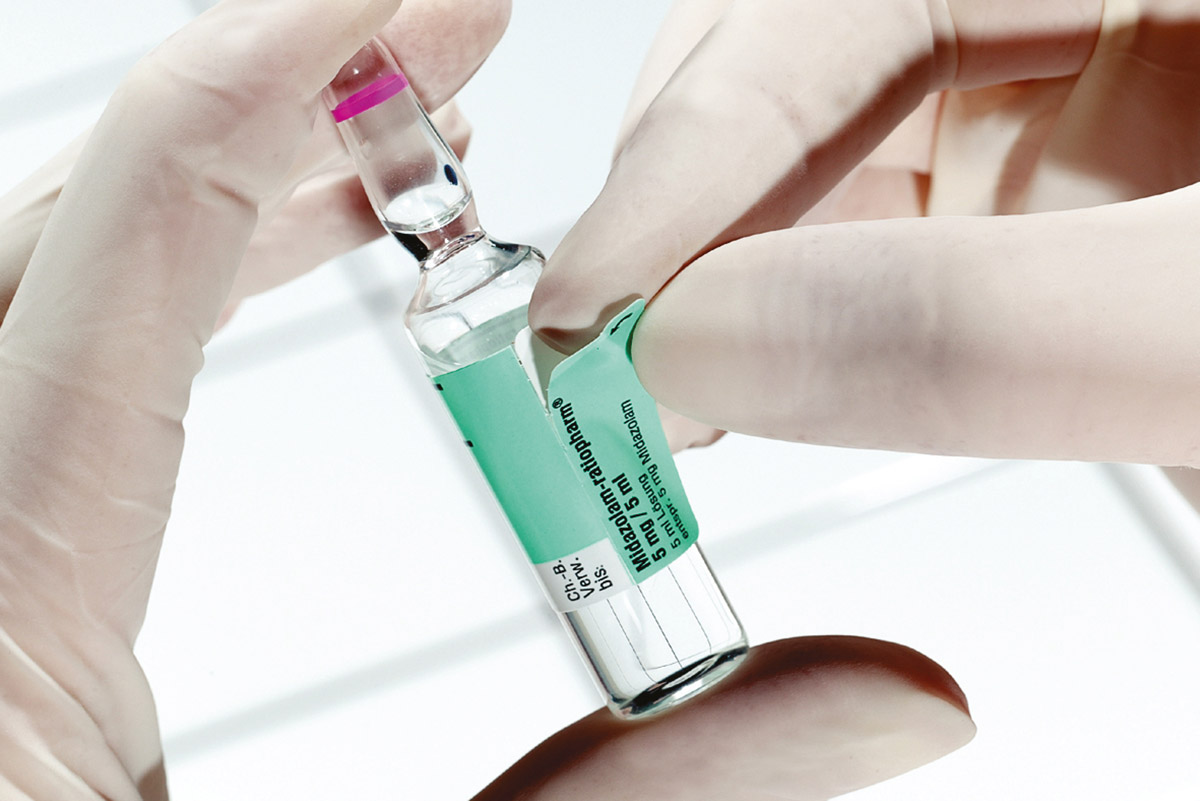
Gestion des lots avec identification UDI pour les produits médicaux et médicaments
Étiquettes UDI avec toutes les informations utiles
La gestion des lots pour les produits du domaine médical est réglementée par la loi sur les produits médicaux du 01/01/1995. Toutes les entreprises qui fabriquent des produits médicaux sont obligées d’indiquer un numéro de lot sur les produits (fabricants, importateurs et vendeurs de produits médicaux). Il est possible, à l’aide des numéros de lot, de lancer, dans certaines circonstances, des actions de rappel pour protéger les consommateurs.
Cette obligation se rapporte notamment à tous les produits implantables, aux diagnostic in vitro et à tous les produits fabriqués à partir de substances animales.
Date butoir 26/05/2020 – fin de la période de transition pour l’entrée en vigueur de la « Medical Device Regulation » (MDR). Les exigences posées par l’UE dans la MDR sont obligatoires pour toutes les entreprises et fabricants du secteur médical. Une exigence centrale de la MDR consiste en la traçabilité des produits au moyen de numéros de lot.
L’application : Marquage des produits médicaux dans le processus de production
Dans le domaine des médicaments, le numéro de lot contient, outre les indications sur le produit, des informations sur la durée de conservation et la date de péremption du produit.
Un marquage normalisé présentant toutes les informations essentielles est la base permettant une traçabilité efficace. Cette norme est l’« UDI », abréviation de « Unique Device Identification » ou « Numéro d’identification du produit » dans le secteur médical.
Elle contient entre autres le numéro de lot du produit. L'UDI se compose de deux parties, l'UDI-DI ("Device Identifier") pour l'identification du produit et du fabricant et l'UDI-PI ("Production Identifier"), qui marque le lot d'un produit. Le marquage UDI constituent la base de la traçabilité et sont disponibles sous une forme uniforme et numériquement lisible.
Toutes les informations, telles que la référence, le GTIN (identification du fabricant et du produit), le numéro de lot et la date de péremption, sont regroupées dans l'"identification unique du dispositif" (UDI) dans un code-barres, souvent sous forme de code-barres 2D, par ex. codes Datamatrix GS1 ou GS1-128, avec une ligne en texte clair pour le consommateur.
L’UDI remplace l’ancienne désignation avec numéro central de pharmacie et la durée minimale de conservation ou date de péremption.
Les avantages : toutes les informations peuvent être saisies en scannant un code-barres, des erreurs dues à des saisies manuelles sont évitées, l’acquisition se fait plus rapidement. L’étiquetage doit être étroitement intégré au processus de production pour éviter des attributions aux mauvaises interfaces.
Selon la directive sur les dispositifs médicaux (MDR), une grande quantité de données sur les dispositifs médicaux doit être stockée dans la base de données européenne sur les dispositifs médicaux (EUDEMED). EUDEMED vise à améliorer la surveillance du marché et à fournir aux autorités compétentes un accès rapide aux informations sur les produits.

La solution : Étiquettes activables par laser – impression sans contact dans le processus d’emballage
Les étiquettes offrent une multitude d’avantages puisqu’elles posent toujours les mêmes exigences au système d’impression et peuvent être appliquées à vitesse constante sans l’emballeuse. Un seul type d’étiquette permet d’étiqueter des tailles de boîtes pliantes différentes.
Les étiquettes activables par laser qui sont imprimées et distribuées « inline » dans le processus d’emballage sont dotées d’une finition spéciale. Elles sont inscrites en noir avec un laser, directement dans le système d’étiquetage.
L’image d’impression est extrêmement nette, même dans des petites tailles, qu’il s’agisse d’écritures, de graphiques et/ou de codes. L’impression résiste aux frottements et rayures.
Le système d’impression ne nécessite aucun consommable supplémentaire et fonctionne sans usure. Les interruptions de production sont ainsi réduites.
HERMA propose non seulement des étiquettes activables par laser mais aussi les unités d’étiquetage et systèmes d’impression correspondants, intégrés aux lignes d’emballage – une solution globale qui est adaptée exactement aux exigences de la production dans le domaine médical.
Les étiquettes en rouleau pour imprimantes à transfert thermique peuvent être imprimées et distribuées de manière décentralisée et près de la production. Toute une série de formats d'étiquette standards sont disponibles dans ce cas. Nous produisons bien entendu des tailles d’étiquettes individuelles, adaptées à votre taille d’emballage. HERMA propose également pour les étiquettes en rouleau imprimées de manière décentralisée des machines d’étiquetage correspondantes à intégrer dans vos emballeuses.

Particularité des étiquettes activables au laser de cette application :
- Solution globale : étiquettes, système d’impression et unité d’étiquetage provenant d’un seul fournisseur
- Étiquettes activables par laser : image d’impression ultra-nette, idéale pour les codes Datamatrix
- Sans usure ni consommables supplémentaires
- Sécurité de processus maximale
Autres solutions intéressantes pour le secteur pharmaceutique
Dans le domaine hospitalier, les étiquettes de documentation assurent une parfaite correspondance entre les médicaments, pansements à agent actif et bandages et le dossier du patient. Ces étiquettes à volets s’utilisent également sur les emballages de vaccins pour documenter le vaccin administré dans les dossiers des patients ou carnets de vaccination. Des parties de l’étiquette ou l’étiquette dans sa totalité sont détachées après le collage de l’étiquette de base et sont recollées sur un autre support (matériau d’étiquette à plusieurs épaisseurs).
La sécurité anti-fraude est un autre aspect important, à ne pas négliger dans le secteur pharmaceutique. Les étiquettes jouent ici un rôle décisif aussi bien comme supports d’informations pour la traçabilité que comme caractéristique de sécurité pour protéger contre la piraterie et comme fermeture d’origine (étiquettes Tamper Evident).
Nous sommes à votre disposition – contactez-nous !
Les solutions personnalisées sont de mise dans le domaine médical. Nous concevons ensemble la solution idéale pour votre application. Nous sélectionnons, parmi un large choix de matériaux adhésifs de notre propre production, la combinaison idéale de matériau adhésif et de colle adhésive, adaptée à vos systèmes d’impression et à vos exigences. N’hésitez pas à utiliser le formulaire de contact pour nous faire part de vos souhaits. Nous vous contacterons dans les meilleurs délais.
En savoir plus sur
Laser Labels : étiquettes LAM pour systèmes de marquage CO2
Étiquettes pour patients et étiquettes de documentation
Protection contre la contrefaçon grâce à la sérialisation dans l'industrie pharmaceutique